收藏
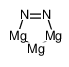
氮化镁,99.99%
CAS号:12057-71-5 分子式:Mg3N2
MDL:MFCD00016205
详情介绍
氮化镁
氮化镁
MAGNESIUM NITRIDE
化合物简介
氮化镁(Mg3N2)是由氮和镁所组成的无机化合物。在室温下纯净的氮化镁为黄绿色的粉末,但含有一部分氧化镁杂质的氮化镁是灰白色的。氮化镁和许多金属氮化物一样,会和水反应产生氨。
基本信息
CAS:12057-71-5
中文别名:
英文别名:trimagnesium dinitride;magnesiumnitride(mg3n2);MAGNESIUM NITRIDE,-325 MESH;Magnesiumnitride(metalsbasis);
分子式:Mg3N2
分子量:100.928
精确质量:99.9613
Psa:24.72
Logp:-0.7616
中文别名:
英文别名:trimagnesium dinitride;magnesiumnitride(mg3n2);MAGNESIUM NITRIDE,-325 MESH;Magnesiumnitride(metalsbasis);
分子式:Mg3N2
分子量:100.928
精确质量:99.9613
Psa:24.72
Logp:-0.7616
编号系统
MDL号:MFCD00016205
PubChem号:24865976
EINECS号:235-022-1
PubChem号:24865976
EINECS号:235-022-1
物化性质
外观与性状:固体
熔点:800ºC
稳定性:Air sensitive. Incompatible with moisture, strong acids, strong bases.
储存条件:库房通风低温干燥,与酸类,含水物品,食品分开储运
熔点:800ºC
稳定性:Air sensitive. Incompatible with moisture, strong acids, strong bases.
储存条件:库房通风低温干燥,与酸类,含水物品,食品分开储运
安全信息
安全说明:S26; S36
危险类别码:R36/37/38
危险品运输编码:UN 2813 4.3/PG 1
危险类别:4.1
包装等级:II
危险品标志:Xi
危险类别码:R36/37/38
危险品运输编码:UN 2813 4.3/PG 1
危险类别:4.1
包装等级:II
危险品标志:Xi
生产方法及用途
生产方法
镁粉在高温下与氮气反应可生成氮化镁。以上反应如果氮气不纯则易生成含氧化镁的产品。在干燥的NH3气中反应的方法就更好些。将镁屑置于瓷舟或烧结氧化镁舟中,舟装在瓷管中,瓷管一端连接T形管,T形管一端可通入干燥的氨气,另一端可通入氮气。瓷管末端连接U形管,管中装有干燥剂,一半是小片状的CaO,另一半是小片状的KOH。反应管排出的气体被吸收装置吸收,吸收装置是两个盛有稀硫酸的锥形瓶。为防止发生倒吸,第一个吸收瓶的导管不要插到稀硫酸液面之下。向瓷管中通入干燥的NH3和N2气,至第二个吸收瓶不再冒出气泡时,说明瓷管内空气已经赶净。升温至800~850℃,加热镁粉4h,镁粉变得炽热,标志着反应的开始,与此同时必有H2产生。反应过程中NH3的气压要大于外界大气压,以免倒吸。反应结束,关闭NH3,保持原来的温度继续通N
镁粉在高温下与氮气反应可生成氮化镁。以上反应如果氮气不纯则易生成含氧化镁的产品。在干燥的NH3气中反应的方法就更好些。将镁屑置于瓷舟或烧结氧化镁舟中,舟装在瓷管中,瓷管一端连接T形管,T形管一端可通入干燥的氨气,另一端可通入氮气。瓷管末端连接U形管,管中装有干燥剂,一半是小片状的CaO,另一半是小片状的KOH。反应管排出的气体被吸收装置吸收,吸收装置是两个盛有稀硫酸的锥形瓶。为防止发生倒吸,第一个吸收瓶的导管不要插到稀硫酸液面之下。向瓷管中通入干燥的NH3和N2气,至第二个吸收瓶不再冒出气泡时,说明瓷管内空气已经赶净。升温至800~850℃,加热镁粉4h,镁粉变得炽热,标志着反应的开始,与此同时必有H2产生。反应过程中NH3的气压要大于外界大气压,以免倒吸。反应结束,关闭NH3,保持原来的温度继续通N
13761527386
 锏鑫微信公众号
锏鑫微信公众号
沪(金)应总管危经许[2024]201219
本网站销售的所有产品不可用于人类或动物的临床诊断或治疗,非药用,非食用。
版权所有:Copyright 2021 网站地图 锏鑫商城
技术支持:上海剑辕科技有限公司

